Poláris és nem-poláris molekulákat
Teljesítmény központok pozitív és negatív töltések a molekulában nem esik egybe egy ponton, de bizonyos távolságot ℓ.
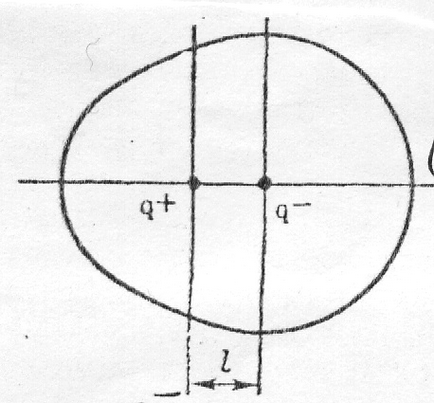
Polar molekula állandó elektromos dipólmomentum
Egy molekula, ami összességében a semlegesség jelentése egy elektromos dipólus töltés q - - y klóratom és q + - a hidrogénatom. Az ilyen kötéseket és a molekulákat nevezik poláris. Díjak az atomok egy nevezett molekula hatásos töltetek q (molekula HCI QCL = -0,18; qn = 0,18 és abszolút felelős egy elektron, a mértéke iontartalma kötés
Mérjük polaritás és a molekula - egy elektromos dipólmomentum (μ - «mu") által meghatározott termék
μ = qℓ, Cl ∙ m vagy μ = qℓ / 3,33 ∙ 10 -30. D
ahol q - a hatásos töltet; ℓ - dipólus hossza. Az egység az elektromos dipól pillanatban (az SI rendszer) által expresszált 3,33 ∙ ∙ Cl 10 -30 m (Coulomb-meter) = 1D (D - Debye).
Az elektromos dipólmomentum - vektor mennyiség. Iránya hagyományosan vett pozitív a negatív töltés - a eltolási irányára az elektron felhő kötőanyag. Minél nagyobb a különbség a elektronegativitási elemek poláris molekulák, a nagyobb az elektromos dipólmomentum.
Mert poliatomos molekulák, különbséget kell tennünk a koncepció dipólusmomentumának az egyes kötvények és a molekula egészének. Mivel a bennük többszörös kötés a molekulában, azok dipólusmomentum vannak kialakítva a szabály alapján a paralelogramma, alakjától függően a molekula által meghatározott tájolt kötések kapott dipólusmomentum eltér a dipólusmomentum az egyes kapcsolatok az adott esetben (magasan molekulák) lehet nulla, annak ellenére, jelentős polaritása az egyes kötések. Például, a nem-poláros CO2 lineáris molekula (μ = 0), míg az egyes C = O kötés jelentős dipólus momentuma (μ = 2,7 D).
2.7 D 2.7 d
Molekulákat, amelyek tartalmaznak egy nem poláris kovalens kötés, úgynevezett nem-poláros vagy unipoláris. Az ilyen molekulák előnyösen szimmetrikusan elosztva elektron felhő között magok a két atom, és a sejtmag egyformán hatnak rá. A példák közé tartoznak az egyszerű anyagok a molekula, amely atomok egyik eleme: H2. Cl2. O2. N2. F2 és mások. Elektromos dipólusmomentuma molekulák nulla.
Az a képesség, a molekulák (és az egyes kötések) polarizálja hatása alatt a külső elektromos mező úgynevezett polarizálhatóságot. Ez akkor fordulhat elő, hatása alatt a területen létrehozott közeledett poláris molekula. Ezért polarizálhatóságának nagy jelentősége van a kémiai reakciókban.
Mindig fontos, hogy figyelembe vegyék a polaritás a molekula és villamos dipólusnyomatékkal. A legújabb kapcsolódó reaktivitás anyagok. Általában, minél nagyobb a villamos dipólusmomentuma a molekula, annál nagyobb a reaktivitás a vegyületet. Egy elektromos dipólmomentum ez is rokon anyagok és oldódnak. Polar folyadékok kedvezőek elektromos molekula disszociációs elektrolitok oldunk benne az elv „mint a feloldódik, mint a”.