Ionos egyenlet - studopediya
A legtöbb kémiai reakciók megoldásokat. Elektrolit oldatok tartalmazó ionokat, és ezért a reakció oldatokat elektrolitok ténylegesen csökken közötti reakciók ionok.
A reakciók között ionok nevezzük ionos reakciókkal, és az egyenletek az ilyen reakciók - ionos egyenletek.
Elkészítésekor ion egyenletet kell vezérelnie a tény, hogy a képlet malodissotsiiruyuschih oldhatatlan anyagot és a gáznemű rögzítik a molekuláris formában.
A fehér anyag kiválik, akkor a következő a állítását lefelé mutató nyílra, és ha szabadul a reakció során gáznemű anyag, akkor a következő a követelések fel nyíl.
Átírjuk az egyenlet, ábrázoló erős elektrolitok ionok formájában, és nyújtás a reakció - formájában molekulák:
Felvettük oly teljes ionos egyenlet.
Ha kivonjuk a két oldala ugyanazokat az ionokat, amely nem vesz részt a reakcióban, hogy a bal és jobb oldalán az egyenlet), kapunk egy csökkentett ionos egyenlet:
Így a csökkentett ion egyenletek egyenletek általános formában, hogy természetének jellemzésére a kémiai reakció jelzi, hogy mely ionok reagálnak, és egy anyag eredményeként képződött.
ioncserélő reakciók folytassa a véget azokban az esetekben, amikor alakított vagy kicsapódnak vagy malodissotsiiruyuschee anyag, mint például a víz. Blancherek a nátrium-hidroxid, a fenolftalein festett bíbor, túlfeszültség felesleges salétromsav oldatot, az oldat elszíneződött, ami jelzi a kémiai reakció:
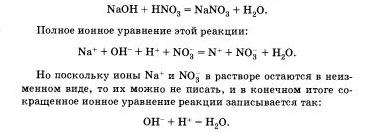
Ez azt mutatja, hogy a kölcsönhatás az erős sav és lúg csökkenti a kölcsönhatás a H + ionok és az OH - ionok, így a formáció malodissotsviruyuschee anyag - víz.
A reakciót közötti erős savas és lúgos úgynevezett semlegesítési reakció. Ez egy speciális esete a csere reakció.
Ilyen cserére reakció előfordulhat nem csak közötti savak és lúgok, hanem között az oldhatatlan savak és bázisok. Például, ha kap oldhatatlan kék csapadékot réz-hidroxid (II) -szulfát, réz II reagáltatva egy alkáli:
majd ossza a kapott csapadékot három részre, és túlfeszültség a csapadékot az első csőbe kénsav-oldat kicsapása egy második cső sósavoldattal, és a maradék a harmadik cső oldat salétromsav mindhárom fiolákban csapadék feloldódik. Ez azt jelentené, hogy minden esetben eltűnt a kémiai reakciót, amely tükrözi a lényeget, és segítségével az azonos ionos egyenletet.
Ahhoz hogy ezt vegye figyelembe a molekuláris, hosszú és rövid ionos egyenletek adott reakciók.
Tekintsük ionos reakciókkal, amelyek előfordulnak a gázképződést. A két cső felöntjük 2 ml nátrium-karbonát és kálium-karbonát. Ezután, az első-fogási sósav oldattal, és a második - salétromsav. Mindkét esetben megfigyelhetjük, jellegzetes „forráspont” miatt a szén-dioxid-kibocsátásra. Írunk a reakció egyenletet az első esetben:
A reakciókat a elektrolit oldatok, eapis kabin segítségével ionos egyenletek. Ezek a reakciók az úgynevezett ioncserélő reakciók, mint az oldatok elektrolitokat kicseréljék ionok. Így két következtetést lehet levonni.
1. A reakciókat vizes oldatai elektrolitok közötti reakciók ionok, és így ábrázolt ionos egyenletek.
Ők könnyebb molekuláris és általánosabb.
2. Az ioncserélő reakció elektrolit oldatok lényegében irreverzíbilisen folytassa csak akkor, ha a kapott csapadék képződik malodissotsiiruyuschee gáz vagy anyag.