Elektrolízis - studopediya
Elektrolízis - egy sor redox reakciók előforduló az elektródák alatt a folyosón egy közvetlen elektromos áram segítségével elektrokémiai rendszer, amely a két elektród és az elektrolit oldat vagy olvadék.
Az elektrolízis egy kémiai reakció által energia az elektromos áram. A katódon a negatív elektród (-), van egy helyreállítási folyamat, az anódnál egy pozitív töltésű elektród (+) - oxidációs folyamat. A reduktív és oxidatív hatása az elektromos áram erősebb, mint a hatása kémiai redukáló szerek és oxidáiószerek. A készülék, amely végzik elektrolízis, az úgynevezett elektrolizáló vagy az elektrolitikus fürdőben. A természet az áramlás az elektrolízis elektróda folyamatok nagymértékben befolyásolja a készítmény az elektrolit, az oldószert, az elektróda anyag és az elektrolízis feltételei (feszültség, áram sűrűség, hőmérséklet, stb).
Különböztesse elektrolízis olvadékok és elektrolit oldatok. Az utóbbi esetben, a folyamat az elektrolízis magában vízmolekulák.
Az elektrolízis olvadékok.
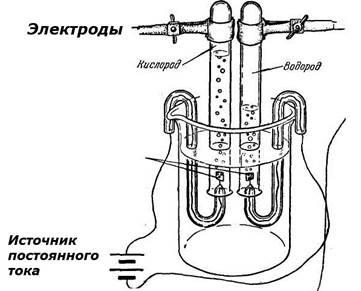
Ha az olvadékot a nátrium-klorid merítse inert elektródák (szén, vas), valamint, hogy adja át a közvetlen elektromos áram, az ionok fog mozogni, hogy az elektródák: Na + kationok a katód, az anionok Cl - - az anód.
Oxidáció történik anód hasznosítás történik, a katód (szavakkal kezdődő magánhangzó „a”) (a szó kezdődik mássalhangzó „k”).
Az anionok - negatív töltésű ionok. Kationok - pozitív töltésű ionok.
nátrium-ionok Na +. elérve a katód, elektronok veszik belőle, és helyreáll; klorid-ion Cl -. így elektronok Anód oxidált. Összesen elektrolízis egyenlet
NaCl → Na + + Cl -
(-) katód: Na + Na + + e → Na
(+) Anód: Cl - 2Cl - - 2e → Cl2
A teljes rendszer az elektrolizáló eljárás során megolvad NaCl 2NaSl → 2Na + Cl2.
Az elektrolízis során az olvadékok tartalmazó oxigéntartalmú anionok, oxigén fejlődik az anódon. Ez annak köszönhető, hogy a formáció az oxidációs az anódon instabil részecskék OH -. SO4 2-, stb azonnal bomlik stabil nemfémes oxid és oxigén.
Reakcióvázlat olvadék elektrolízise nátrium-szulfát lehet az alábbi képlettel ábrázolható:
(-) katód: Na + 2Na + + 2e → 2 Na
A teljes rendszer a folyamat az elektrolízis olvad Na2 S04
Az elektrolízis a megoldásokat.
Ha figyelembe vesszük a vizes oldatok elektrolízisével kell venni, hogy amellett, hogy az elektrolit-molekulák, vízmolekulák is alávethetjük, hogy egy elektrokémiai oxidáció vagy redukció. Ebben az esetben szükség van, hogy vegye figyelembe a kapacitás értéke a helyreállítási folyamat a hidrogén-ionok amely függ a koncentrációja H +. A semleges közegben értéke pedig -0,41 V. Sequence kationok kisütés az elektrolízis segítségével állítható be az elektrokémiai feszültség sorozat.
1. kationok a fémek, amelyek potenciális értékét lényegesen negatívabb, mint -0,41 V (hidrogéngáz-fejlődés potenciális) csökken, a katódon (beleértve a lítium-alumínium) és a vízmolekulák csökkentett;
2. kationok a fémek, amelynek standardpotenciál közeli érték az érték a hidrogén-fejlődés potenciálja (a középső része egy sor fémek Zn, Cr, Fe, Cd, Ni) csökkennek a katód mellett vízmolekulák;
3. A kationok a fémek, amelynek standardpotenciál magasabb, mint a hidrogén-fejlődés potenciálja az elektrolízis gyakorlatilag teljesen redukált a katódon.
Amikor a vizes oldat tartalmazza a kationok különböző fémek, a kiválasztás az elektrolízis a katód fog folyni csökkenő sorrendben a algebrai értékeinek standardpotenciál. Így egy keveréket az Ag + kationok. Cu 2+. Fe 2+ először talpra ezüstkation (E o = + 0,80 V), majd a réz kationok (E o = 0,34 V), és az utolsó - vas kationokkal (E o = - 0,44 V). A természet a fellépő az anódon függ vízmolekulák jelenlétében, és az anyag, amelyből az anód készül. Megkülönböztetése oldhatatlan és oldható anódok.
Oldhatatlan anódok grafitból készült, platina. Az elektrolízis, az oldhatatlan anódok ne küldjön elektronok egy külső áramkör-, azok feltöltését végzi az oxidációs anionok és víz molekulák. Ebben az esetben, anionok: hidrogén savak, ha azok elegendő koncentrációban oxidált elég könnyen. Ha az oldat anionokat tartalmaz oxigéntartalmú savak (SO4 2- NO3 -.... CO3 2- és PO4 3- stb), akkor az anód nem oxidálódik ezen ionok és vízmolekulák.
Attól függően, hogy a pH-oldatok vizes oxidáció végbemegy másképp. A lúgos környezetben, van egy reakció 4ON - - 4. = O2 + 2H2 O.
A savas vagy semleges közegben 4e + 2H2 O = O2 + 4H +.
Ezekben az esetekben, a elektrokémiai oxidáció víz a leginkább energetikailag kedvező folyamatot. Oxigéntartalmú anionok vagy nem képes oxidálni, vagy oxidáció megy végbe, nagyon nagy lehetőségeket. Például, az oxidációs potenciálját az ionok SO4 2-
Ez egyenlő 2,01 V, ami lényegesen magasabb, mint az oxidációs potenciálját víz 1,23 V.
Abban az esetben, ha egy oldhatatlan anód, az elektronok a külső áramkörben elküldi az anód is. Oldható anódok anyaga réz, ezüst, cink, kadmium és mások.
Tekintsük több példát vizes oldatok elektrolízisével elektrolitok. Elektrolízis a koncentrált oldat kálium-jodid szén elektródok.
Az oldatban gidrotirovannye ionok és a K + J -. valamint egy vízmolekula. Amikor áram folyik át az oldaton, a K + kationok elmozdulni a katód, az anionok J - - az anód. Azonban, a reakciók végbemenetelét az elektródok lényegében különbözik a reakciókat olvasztott sók. Így, a katód helyett kálium-ionok (a sorban feszültség az, hogy ő alumínium) kinyerjük egy vízmolekula. Reakcióvázlat KJ elektrolízis oldatba szén elektródok ábrán látható.
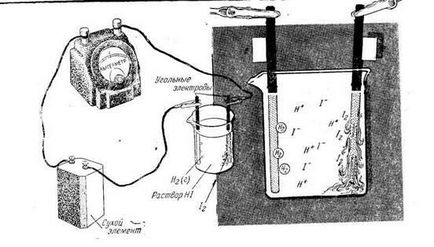
Reakcióvázlat elektrolízis KJ (oldat)
Reakcióvázlat elektrolízis KJ → K + + J -
A teljes rendszer a folyamat az elektrolízis KJ 2 + 2H2 O → H2 ↑ + 2KOH + J2 ↑.
Ennek eredményeként az elektrolízis a katódon hidrogén szabadul fel az anódon - jód felhalmozódik a katód térben kálium-hidroxid.
Elektrolízis kálium-szulfát szén elektródok. Mivel a kálium az elektrokémiai sorban jelentősen korábbi, mint hidrogénatom, akkor a katód helyreáll a víz, felhalmozódnak és engedje hidrogén-ionok OH -. Abban az anód, az oxigén ionokat és H + halmozódnak. Keverés közben, ez lesz a semleges oldatot. Vezetési elektrolízis
A teljes rendszer az elektrolizáló eljárás során
A elektrolízise vizes kálium-szulfát csökken a elektrolizált víz