A polaritás molekulák (típusú kovalens molekulák)
Meg kell különböztetni a polaritás a molekulák polaritását a kapcsolat. A kétatomos molekulák AB típus, ezek a fogalmak jelentése ugyanaz, mint a már bemutatott példában HCI molekulában. Az ilyen molekulák, annál nagyobb a különbség a elektronegativitási elemek (# 8710; EO), annál nagyobb a villamos dipólmomentum. Például, egy sor HF, HCI, HBr, HI, hogy csökken a szekvenciája ugyanaz, mint a relatív elektronegativitási.
A molekulák lehetnek poláros és nem-poláros, jellegétől függően az eloszlása az elektronsűrűség a molekula. Polaritás jellemzett molekulákból az érték az elektromos dipólmomentum # 956; m. amely egyenlő a vektoriális összege villamos dipólusnyomatékuk kötvények és a nem kötő pár elektronok molekulák. Az eredmény a kívül függ a polaritás a csatlakozások, a geometriai szerkezetét a molekula, a jelenléte nem megosztott elektron pár. Nagy hatással van a polaritás a molekula a szimmetria.
Például, CO2 lineáris molekula szimmetrikus szerkezetű:
Ezért, míg a C = O, és van egy erősen poláros karakter miatt a kölcsönös kompenzáció azok villamos dipólusnyomatékuk a CO2 molekula általában nem-poláros (). Emiatt, apoláris nagymértékben szimmetrikus tetraéderes CH4 molekula. CF4. oktaéderes molekula SF6 és t. d.
Ezzel szemben, a sarokban a H2O molekula poláris kötések O-H szögben 104,5º. Ezért ezek a pillanatok nem semlegesítik egymást, és a molekula poláris ().
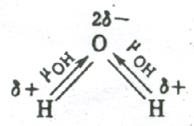
Elektromos dipólus momentum is mutatnak szögletes SO2-molekula. piramis NH3 molekulák. NF3 és t. D. A hiányában egy pillanatra
jelzi nagymértékben szimmetrikus a molekula szerkezete, a jelenléte a villamos dipólusnyomatékkal - a aszimmetria molekuláris szerkezete (lásd 3.2 táblázat.).
Szerkezete és várható polaritása molekulák
Az értéke az elektromos dipól pillanatban a molekulák erősen befolyásolja a nem kötő elektronpár. Például, NH3 és NF3 molekulák egyaránt trigonális-piramis alakú, polaritású kötvények N-H és N-F is körülbelül azonos. Mindazonáltal az elektromos dipólus momentuma az NH3 0,49 · 10 -29 m · Cl, NF3 és 0,07 · 10 -29 · Cl m. Ez annak a ténynek köszönhető, hogy az NH3 irányt a villamos dipólmomentum N-H kötés és a nem kötő elektronpár egybeesik vektor mellett vezet egy nagy elektromos dipól pillanatban. Ezzel szemben, a pillanataiban NF3 N-F kötések és elektronpár ellentétes irányban, így azok részben ellensúlyozza a felül (ábra. 3.15).
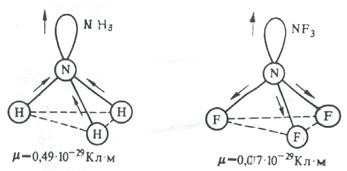
Ábra 3.15. Hozzáadása villamos dipólusnyomatékuk és a ragasztás a nem kötő elektronpár molekulák NH3 és NF3
Apoláros molekula lehet poláris. Ehhez meg kell helyezni az elektromos tér egy bizonyos potenciál különbség. Az elektromos mező „súlypontok” a pozitív és negatív töltések tolódnak és van indukált, illetve indukált elektromos dipólmomentum. Amikor eltávolítja a területen ismét válik egy nem poláros molekula.
Hatása alatt a külső elektromos tér egy poláris molekula polarizált, azaz a. E. Van jelentkezik töltés-újraelosztó és a molekula lesz az új érték a villamos dipólusnyomatékkal lesz még poláris. Ez akkor fordulhat elő, hatása alatt a területen létrehozott közeledett poláris molekula. Az a képesség, a molekulák polarizálja hatása alatt egy külső elektromos mező úgynevezett polarizálhatóságot.
Polaritását és polarizálhatóságának a molekulák miatt intermolekuláris kölcsönhatások. Az elektromos dipólusmomentuma a molekula kapcsolódik reaktivitás anyag, annak oldhatóságától. Poláris folyadék molekulák kedveznek elektrolitos disszociáció oldott elektrolitok bennük.
Amikor két atom, rendkívül eltérő electronegativities, a teljes elektronpár eltolható gyakorlatilag teljesen az atom egy nagyobb elektronegativitása. Ennek eredményeként két töltött részecskék - két ion, amelyek között hatnak az elektrosztatikus vonzóerő.
Feedback, amely által végrehajtott képező elektrosztatikus kölcsönhatás, és ellentétes töltésű ionok, az úgynevezett ion.
Például, egy ionos kötés előfordul a cézium és a fluor, amelyben EO különbség több, mint három egység. Tipikus vegyületek, amelyek egy ionos kötést közé tartoznak az alkálifém-halogenidek, mint a CSF, CsCI, NaCl.
Az ionos kötés jellemzi:
- Körsugárzó. mivel az elektromos mező van egy gömb alakú ion jellegű és minden irányban;
- telítetlen. mint az interakció az ionok nem kerül sor teljes kölcsönös kompenzációja erőterek (ábra. 3,16) ionok és megtartják azt a képességüket, hogy elektrosztatikus kölcsönhatásba lép más ionokkal.
Hiánya miatt az ionos kötést irányultság és telíthetőségével egyes ionok körül ionok ellenkező előjelű, amelyek száma határozza meg a méret és a taszító erő, mint a töltött ionok. Ezért vegyületek ionos kötések kristályos anyagok. A teljes kristályt lehet tekinteni, mint egyetlen óriási molekula, amely a nagyon nagy számú ionok. Csak magas hőmérsékleten, amikor az anyag bejut a gáz halmazállapotú, ionos vegyületek formájában létezhetnek nem társított molekulák.
Az elmélet az ionos kötés alakult ki 1916-ban a német tudós W. Kossel. Ezen elmélet szerint, a stabil konfiguráció egy hüvely inert gáz s 2 p 6. valamennyi atom részt vevő kémiai kölcsönhatás, kívánja szerezni búra stabil inert gáz. Amikor ez a fém atomok adják vegyérték elektronok, megszerzése előző inert gáz borítékot, és egy pozitív töltést. Nemfémes atomok felvesznek elektronokat, megszerzése későbbi boríték inert gáz és a negatív töltés. Például:
K 2 3s 4s 3P 6 1 - 1e # 713; K + 3s 3p 2 6;
F 2s 2 2p 5 + 1e # 713; F 2s 2 2p 6.
Komplett átadása egy elektront egy atomot egy másik a valóságban nem fordul elő még a tipikus ionos vegyületek - alkáli-halogenidek. Például, egy kristály NaCl hatásos negatív töltés klóratom csak 0,94 elektron töltése; ugyanolyan abszolút értékű pozitív töltéssel rendelkezik, és egy nátrium-atom. Lehetetlen, hogy végezzen pontos határ között ionos kötést és egy poláros kovalens kötés, csak a mértéke iontartalma a kötés lehet értékelni, amely mennyiségileg a hatásos töltetek atomok (d) a molekulában. Elmondhatjuk, hogy az ionos kötés, amelynél határesetben a poláris kovalens kötés, amelynek effektív felelős atomok abszolút értékben, az egységhez közeli. Úgy vélik, egy ionos kötést, ha a különbség a electronegativities atomok (DEO) nagyobb, mint 1,9 vagy ½d½> 0,5. Így a kémiai kötés természete az egyik, és van egy különbség a típusú kapcsolatok kvantitatív.
1.Iony van egy polarizáló hatás - a képesség, hogy deformálódik, hogy kiszorítja az elektron héj szomszédos ion. Jelentős mértékben vannak az ingatlan kationok. A polarizáló akció függ egyrészt a töltés és ion sugara, annál nagyobb a költség és a kisebb ion sugara, annál erősebb a polarizáló hatása. Például:
a) Pb 0 Pb2 + Pb 4+
r, Å 1,74 1,32 0,84
polarizáló hatás fokozódik;
b) Li + Na + K + Rb + Cs +
ion sugara növekszik, a polarizáló hatás csökken.
Másodszor, a több elektront a fém kation külső energia szintje, annál több a polarizáló hatását. Például, többek között: Ca 2+ (8e # 713;) 1, Fe 2+ (14e # 713;), Zn 2+ (18e # 713;) a polarizáló hatását az ionok növekszik.
2. polarizálhatóságot - ion az a képesség, hogy deformálódik a cselekvés az elektromos mező szomszédos egy ion. Y ionok ugyanolyan töltéssel és ugyanazt a szerkezetet a külső elektronsugár héj a polarizálhatóságot növekedésével nő mérete az ionok. Például:
a) Li + Na + K + Rb + Cs +
ion sugara növekszik, a polarizálhatóságot növekszik;
ion sugara növekszik, a polarizálhatóságot növekszik.
Könnyebb polarizált negatív töltésű ionok (anionok). Méretük összehasonlítva azokkal az atomokkal növekszik, a közötti taszítás az elektronok növekszik, és a polarizálhatóságot növekszik. Az első közelítésben, akkor feltételezhetjük, hogy a törzs van kitéve csak a külső elektron héj a ion.
A név „fém kötés” azt jelenti, hogy elsősorban a belső szerkezete a fémek.
Atomjai a legtöbb fém a külső energia szinten tartalmaznak kisszámú vegyérték elektronok képest az összes külső energetikailag közel pályák, és a vegyérték-elektron-Rhone miatt az alacsony ionizációs energiája gyengén tartott az atom. Ezért energetikailag előnyösebb, hogy az elektronok nem lokalizált, és tartozó minden fém. Így az egyik elektron tartalmaznak 16 elemeket, és két - 58, 3-4 elem és sem th - csak egy Pd. Csak atomok elemek Ge, Sn és Pb a külső elektron 4. szintű, antimon és bizmut - 5 és Ro - 6. Azonban, ezek az elemek nem jellemző a fémek.
Elements - fémek alkotnak egyszerű anyagok. Normális körülmények között, ez a kristályos anyagot (kivéve a higany). Az elmélet szerint a „szabad elektronok” a fémrács oldalak pozitív töltésű ionokat, amelyek merítjük egy elektronikus „gáz”, eloszlik a fém vegyértékével lokalizált elektronok. Két pozitív töltésű fémionok és a nem-lokalizált elektronok létezik elektrosztatikus kölcsönhatást, amely rezisztenciát anyag.
Ábra. 3.17 ábra egy diagram a kristályrács fémnátriumot. Ez minden nátrium-atom körül nyolc szomszédos atomokban. Egy példa erre, úgy egy fémes kötést anyag.
Egy nátrium-atom, mint minden fémek, van egy vegyértéke pályák feleslegben és hiányosság az elektronok. Így, annak vegyérték-elektron (3s 1) egyikét veheti a 9 álló pályák: 3s (egy), Sp (három) és a 3D (öt). Amikor közeledik atomok, így a képződését kristályrács vegyérték pályák szomszédos atomból újra kryvayutsya, ahol az elektronok szabad mozgását egyik orbitális másik elvégzésével közötti kommunikáció az összes fém atomjai a kristály (ábra. 3.18).
Így, a fémes kötés - erősen lokalizált kémiai kötés fordul elő, amikor atomok vegyérték elektronok kis mennyiségéhez viszonyítva a szabad vegyérték pályák, és a vegyérték elektronok az alacsony ionizációs energia gyengén birtokában a kernel.
Fémes kötés némi hasonlóságot kovalens, mivel alapul általánosítása a vegyérték elektronok. Azonban, amikor a kovalens kötés -ról csak két vegyérték elektronok a szomszédos-atomok, míg ha a fémes kötés a szocializált-SRI ezek az elektronok összes atom vesz részt. Ez a kristály, amelynek egy kovalens kötés törékeny, és egy fém - műanyag; Az utóbbi esetben, a lehetőségét, kölcsönös elmozdulását az ionok és elektronok feltörése nélkül a kapcsolatot. Ez azt mutatja, a nem-lokalizációs (jelenlétében on-irányban) a fém kapcsolat. Szabad elektronok, hogy szabadon mozoghat az egész mennyiség a kristály biztosítja a magas elektromos vezetőképesség és hővezető, valamint a képlékenység. Fémes csillogás visszaverődése miatt a fénysugarak az elektron gáz, ami egy kicsit a határon túli pozitív töltésű ionok. Ez egy fémes kötés magyarázza a fémek fizikai tulajdonságainak.
A fémes kötés jellemző fémek a szilárd és folyékony állapotban. Ez a tulajdonság az aggregátumok atomok közvetlen közelében található egymáshoz. Azonban elpárologtatott fématomok, valamint az összes anyagokat kovalens kötés. Pary”fémek állnak az egyes molekulák (és kétértékű). A kötés erőssége a kristályban, mint a molekulában a fém, így a formáció fém kristály bevételt felszabadulása energiával.