komplex vegyületek
Komplex vegyületek molekuláris vagy ionos vegyületek összekapcsolódásával képződő ion vagy fém atom vagy egy nemfém, semleges molekulák vagy egyéb ionok. Képesek létezik egy kristály, és az oldatban.
Alapvető kifejezések és fogalmak koordinációs elmélet.
Kifejtse a szerkezetét és tulajdonságait a komplex vegyületek 1893-ban svájci kémikus és Werner javasolták koordinációs elmélet amelyben bevezette két fogalom: a koordináció és a kiegészítő vegyértéke.
Werner fő úgynevezett vegyérték vegyértékű keresztül amely atomokat alkotnak egyszerűbb vegyületek engedelmesség elmélet
vegyérték. Azonban, fárasztó a fő vegyérték atom hajlamosak a további kapcsolat révén járulékos vegyértékű kapott megnyilvánulások komplex vegyület képződik.
Az intézkedés alapján az erők és a fő segédanyag vegyérték atomok hajlamosak maguk körül egyenletesen ionokhoz vagy molekulákhoz, és ezért a súlypont. Az ilyen atomok nevezzük központi vagy komplexképző szereket. Ionok vagy molekulák közvetlenül kapcsolódnak a komplexképző szert, az úgynevezett ligandumok.
Keresztül a fő vegyértéke ionok ligandumok kapcsolódnak, és ezen keresztül a kisegítő vegyértéke - ionok és molekulák.
Az attrakció a ligandum kelátképzővé nevezett koordináció, és a szám a ligand - koordinációs számú komplex.
Azt lehet mondani, hogy a komplex vegyület egy olyan vegyület, ahol a molekulák egy központi atom (vagy ion) közvetlenül kapcsolódik egy bizonyos számú más molekulák vagy ionok úgynevezett ligandumok.
A szerepe komplexképző fémkationok gyakran jár (Co +3. Pt +4. Kr +3. Cu +2 +3 Au et al.)
A ligandum hathat ionok Cl -. CN -. NCS -. NO2 -. OH -. SO4 2- és semleges molekulák NH3. H2 O, aminok, aminosavak, alkoholok, tioalkoholok PH3. észterek.
A számos koordinációs helyek ligandum által elfoglalt komplexképző körülbelül az úgynevezett koordinációs kapacitás vagy fogazott.
A ligandumok csatolt egy kelátképző egyszeres kötés, elfoglalják egy koordinációs helyet nevezzük monodentatnymiya (Cl -. CN -. NCS -). Ha a ligandum kapcsolódik a kelátképző keresztül több kapcsolat, ez egy többfogú. Például: SO4 2-. CO 3 2- vannak kétfogú.
És komplexképző ligandumok képezik a belső gömb vegyületet vagy komplexet (komplex képletek szögletes zárójelben). Az ionok nem közvetlenül kapcsolódó kompleksoobrazvatelem alkotják a külső koordinációs szférában.
Ionok a külső gömb van kapcsolódó kevésbé erősen összehasonlítva ligandumok és térben eltávolítjuk a komplexképző szer. Ezek könnyen helyettesíthető más ionok vizes oldatok.
Például, a vegyület K3 [Fe (CN) 6] komplexképzőt Fe +2. iigandumok - CN -. A két ligandumok kapcsolódnak miatt a fő vegyérték és 4 - miatt másodlagos vegyértékei így koordinációs száma hat.
Fe +2 ion ligandumokkal CN - alkotják a belső gömb vagy komplex. és K + ionok külső koordinációs szféra:
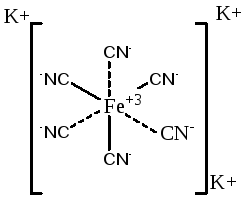
Jellemzően koordinációs szám kétszeresével egyenlő felelős a fémkation, mint például egyszeres töltésű kationokat egy koordinációs száma 2, 2-töltő - 4 és 3 töltők - 6. Ha az elem mutat egy változó oxidációs állapotban, és növelje a koordinációs számának növekedésével. Egyes komplex koordinációs száma állandó, például: Több mint három. Pt 4. Cr +3 van egy koordinációs száma 6, y +3 ionok. Legyen 2. Cu 2. Au +3 koordinációs száma 4. A legtöbb ion koordinációs száma változó, és természetétől függ az ionok és a külső gömb a komplexképződés feltételeket.