ionos egyenletek
ionos egyenletek
Mint azt már tudja a korábbi leckék a kémia, a legtöbb kémiai reakció zajlik megoldás. És mivel az összes elektrolit oldatok közé ionok, lehetséges, hogy azt mondják, hogy a reakciót az elektrolit oldatok redukáljuk közötti reakciók ionok.
Ezek a reakciók között előforduló ionok nevezzük ionos reakciókkal. A ionos egyenlet - éppen az egyenlet ezeket a reakciókat.
Általános szabály, hogy az ionos egyenletet a reakciót nem kapunk a molekuláris egyenletek, de ez alá ezeket a szabályokat:
• Először is, a képletekben gyenge elektrolitok, valamint oldhatatlan és rosszul oldódó anyagok, gázok, oxidok, stb formájában ionok nem kerül rögzítésre, kivétel ez alól az ion HSO-4, majd hígított formában.
• Másodszor, ionok formájában, jellemzően általános képletű erős savak, lúgok, és a vízben oldódó sók. Azt is meg kell jegyezni, hogy ez a képlet, mint a Ca (OH) 2 kerül bemutatásra az ionok formájában, abban az esetben, amikor a mész vízben. Ha a tej meszet használnak, amely részecskéket tartalmaz oldhatatlan Ca (OH) 2, a képlet a ionok formájában nem rögzíti.
Kidolgozásakor az ionos egyenletek hajlanak arra, hogy teljes és rövidített ion, vagyis a rövid távú ionos egyenlet. Ha figyelembe vesszük, hogy az ionos egyenlet, amely rövidített formában van, akkor azt nem tartja be az ionok, azaz nem létezik mindkét oldalán a teljes ion egyenletet.
Nézzük meg példákat, hogy a molekuláris írva, hosszú és rövid ionos egyenletek:
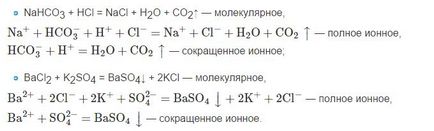
Ezért emlékeztetni kell arra, hogy a képletek az anyagok, amelyek nem töredeznek föl, valamint oldhatatlan és gáznemű ion előállítására egyenletek általában írt molekuláris formában.
Azt is figyelembe kell venni, hogy ha az anyag kicsapódik, a következő képlet segítségével képviseli a lefelé nyíl (↓). Nos, abban az esetben, ha a gáznemű anyag a következő képletet kell lennie, egy ikon egy felfelé mutató nyíl (↑) szabadul a reakció során.
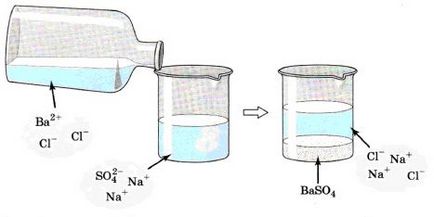
Vessünk egy közelebbi pillantást egy példát. Ha van egy nátrium-szulfát-oldattal Na2SO4, és adjuk hozzá a bárium-klorid-BaCl2 (ábra. 132), azt látjuk, hogy már kialakult fehér csapadékot bárium-szulfát BaSO4.
Nézd figyelmesen a kép mutatja a kölcsönhatás a nátrium-szulfát és bárium-klorid:
Most levelet molekuláris reakció egyenletet:
Nos, most írjuk át ezt az egyenletet, ahol erős elektrolitok képviseli ionok, és a reakciókat, hogy menjen ki a hatálya alól, a bemutatott formában molekulák:
Mielőtt felvettük a teljes ionos egyenletet.
Most megpróbáljuk eltávolítani az egyik m másik oldalán az egyenlet ugyanaz ionok, tehát azok, ionok, amelyek nem vesznek részt a reakcióban 2Na + 2 Cl és akkor kapnánk a rövidített ionos egyenletet, amely a következő formában:
Ebből az egyenletből láthatjuk, hogy az egész lényege ennek a reakció csökken a kölcsönhatás a bárium-ionok Ba2 + és a szulfát-ionok
és BaSO4 képződött csapadékot még csak nem is függetlenül attól, hogy egy eredményt, az elektrolit, amely tartalmazza ezen ionok reakció előtt.
Hogyan lehet megoldani az ionos egyenlet
És végül, foglaljuk össze a leckét, és meghatározza, hogyan kell megoldani az ionos egyenletet. Azt már tudjuk, hogy a reakciók fordulnak elő megoldások elektrolitok között az ionok ionos reakciók. Ezek a reakciók megoldására tett vagy leírt segítségével ionos egyenletek.
Továbbá, emlékezni, hogy az összes ilyen vegyületek, amelyek az illékony, nehéz oldható vagy Kis- disszociált megoldást találni molekuláris formában. Továbbá, nem szabad elfelejteni, hogy abban az esetben, ha a kölcsönhatás az elektrolit oldat képződik bármelyike a fenti típusú vegyületek, ez azt jelenti, hogy a reakciókat gyakorlatilag nem fordul elő.
Feltételek ionos oldatok egyenletek
Egy vizuális Például, hogy egy oktatási rosszul oldódó vegyületek, mint például:
Na2SO4 + BaCl2 + = VaSO4 2NaSl
Az ionos formája a kifejezés lesz:
2Na + + SO42 + Ba2 + + 2Sl- = BaSO4 + 2Na + + 2Sl-
Mivel látjuk, hogy a reakció, hogy egy bárium-ionok és szulfátionok, és más ionok nem reagált, és az állapotuk nem változott. Ebből az következik, hogy egyszerűbbé tesszük az egyenletet és írd rövidítve:
Ba2 + + SO42 = VaSO4
Most ne feledjük, hogy mi kell foglalkozó ionos egyenletek:
• Először is ki kell zárni mindkét oldalról ugyanaz ionok;
• Másodszor, nem szabad elfelejteni, hogy az összeg elektromos töltések az egyenlet azonosnak kell lennie, és az ő jobb oldalán, továbbá a bal oldalon.