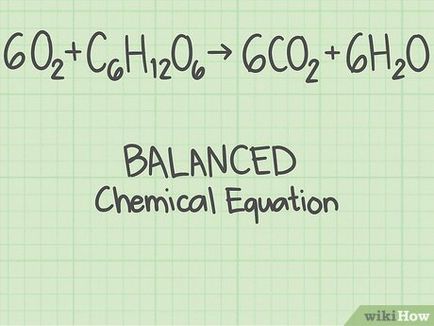
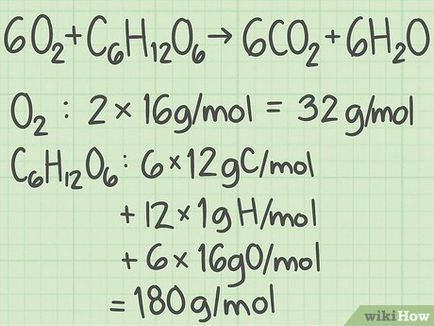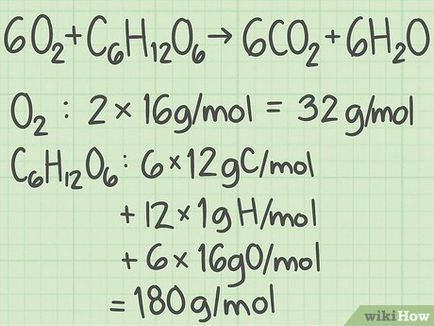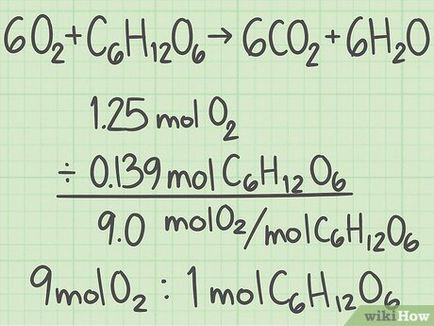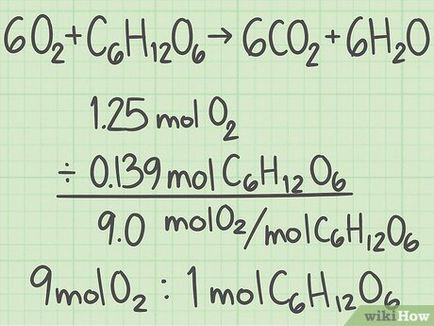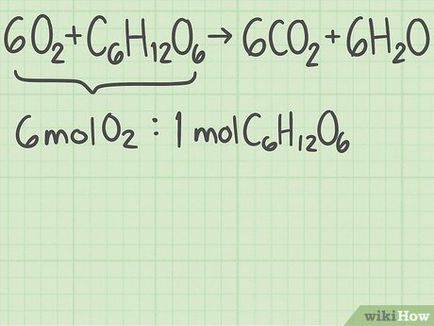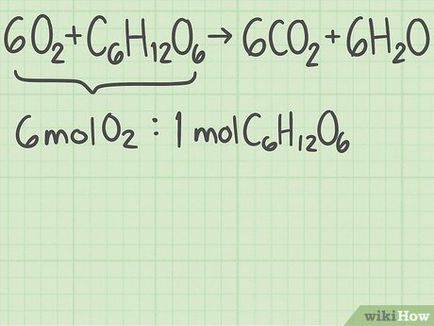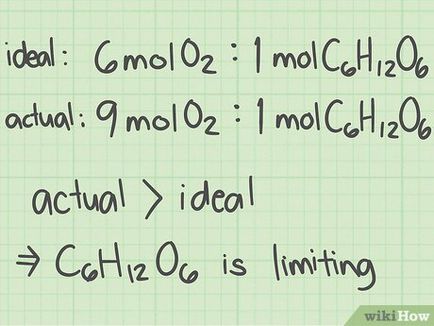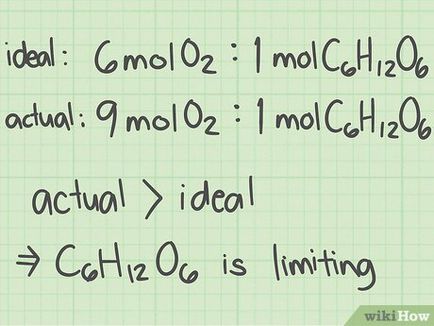Kezdjük egy kiegyensúlyozott kémiai egyenlet. Kémiai egyenlet magában foglalja reagensek (balra egyenlőségjel), és a képződött termékek (jobbra az egyenlőségjel). Bizonyos problémák adott kémiai egyenlet, és mások meg kell írni. A kémiai reakciók atomok nem jönnek létre, vagy elpusztult, de minden elemnek azonos atomok száma a bal és jobb az egyenlőségjel. [1]
- Például úgy, hogy a reakció az oxigén és a glükóz termelt szén-dioxid és oxigén: 6 O 2 + C 6 H 12 O 6 + C_H_O_> → 6 C O 2 + 6 H 2 O + 6H_O>
Mindkét oldalán az egyenlőségjel 6 szénatomot (C), 12 hidrogénatomok (H) és a 18 oxigén atomok (O). Az egyenlet kiegyensúlyozott.
- Olvassa el ezt a cikket, ha kell saját feladata, hogy írjon egy egyenletét.
Get a moláris tömege egyes kiindulási anyag. Határozza meg a moláris tömege minden egyes anyag az atom, majd szeres moláris tömegeket, hogy kiszámítja a teljes moláris tömege anyagok. Ezt egy reagens molekula.
- Például, egy molekula oxigén (O 2>) két oxigénatom.
- Móltömeg oxigén közelítőleg egyenlő 16 g / mol (lásd aktuális értéket a periódusos).
- 2 oxigénatom x 16 g / mol = 32 g / mol O 2>.
- Móltömeg a másik reagens, glükóz (C 6 H 12 O 6 H_O_>), jelentése: (6 szénatomos x 12 g / mol) + (12 hidrogénatomok x 1 g / mol) + (6 oxigénatomot x 16 g / mol ) = 180 g / mol.
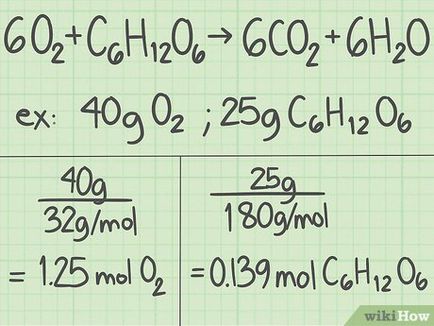
Konvertálása a súlya az egyes reaktáns grammban mol. Most tekintsük a reakció, hogy fogsz költeni. Tömegét feljegyezzük minden egyes reagens grammban. Az így kapott értéket ossza el ezt a moláris tömege egy anyag transzformálására g-mól. [2]
- Például, ha van 40 g oxigén és 25 g glükózt.
- 40 g O 2> / (32 g / mol) = 1,25 mól oxigén.
- 25 g C 6 H 12 O 6 H_O_> / (180 g / mol) ≈ 0139 mol glükóz.
Find a reagensek mólaránya. Vegye figyelembe, hogy a mol - egy érték, amelyet felhasználunk a vegyészek A „számláló” molekulákat. Eldöntötte a molekulák száma az egyes kiindulási anyag. Osszuk a móljainak száma egyik reagens móljainak a másik, hogy keresse a mólaránya a két reagenst.
- Elvette 1,25 mol oxigén és 0,139 mol glükóz. A mólarány az oxigén és a glükóz 1,25 / 0,139 = 9. Ez azt jelenti, hogy egy molekula glükóz esik 9 oxigén molekulák.
Keresse meg a legjobb reagensek aránya. Vissza a egyenletét, amely korábban felvett. Ezzel egyenletet, meg lehet határozni az optimális arányt a reagenseket, azaz az arány, amelynél a két anyagot használnak fel egyszerre.
- Bal oldalon a 6. egyenlet O 2 + C 6 H 12 O 6 + C_H_O_>. Azaz, per 1 molekula glukóz-6 oxigén molekulák tartoznak. Az optimális reagensek arányát: oxigén 6/1 glükóz = 6.
- Ne keverje össze az anyagokat, amelyek a számláló és a nevező a frakció. Ha elosztjuk az oxigén glükózzá, majd glükózt oxigén, akkor kap egy hibás eredményt.
Hasonlítsa össze az arányt megtalálni kulcseleme a reakciót. A kémiai reakció egyik reagens fogy gyorsabb, mint a másik. Egy ilyen kulcsot reaktáns határozza meg a kémiai reakció sebessége. Hasonlítsa össze a két arány, hogy már kell kiszámítani, hogy megtalálja a kulcsot reagens: [3]
- Ha a mólarány nagyobb optimális, olyan anyag, amely a számláló is. Így olyan anyag, amely a nevezőben a kulcs reagens.
- Ha a mólarány kisebb, mint az optimális, olyan anyag, amely a számlálóban, túl kicsi, és ez a legfontosabb reagens.
- Ebben a példában a mólarány (oxigén / glükóz = 9) fölött az optimális arányt (oxigén / glükóz = 6). Így egy olyan anyag, amely a nevezőben (glükóz), kulcsfontosságú reagens.