Alapfogalmak kémia
- A tudomány az anyagok, azok tulajdonságai és átalakulások eredményeként bekövetkező kémiai reakciók, valamint az alapvető törvényeket, amelyekre ezek az átalakulások. Mivel minden anyag áll atomok, amelyek miatt a kémiai kötéseket képezhet molekulákat, a kémia részt főleg tanulmányozása közötti kölcsönhatások atomok és molekulák eredményeként kapott ilyen kölcsönhatások.
- amelynek egy bizonyos fajta atom nevét, a sorozatszámot, és helyzetét a periódusos nevezzük kémiai elem. A jelenleg ismert kémiai elemek 118, befejező Uuo (Ununoctium - Ununoctium). Minden egyes elem által kijelölt szimbólum jelentése egy vagy két betű az a latin neve (azonosított melyet a H betű H - első levél Hydrogenium a latin neve).
- anyagfajtában speciális kémiai és fizikai tulajdonságai. A készlet az atomok, molekulák vagy atomi részecskék, amely egy bizonyos állapotban aggregáció. Az anyagok állnak a fizikai szervek (réz - anyag rézérme és - fizikai test).
- álló anyag atomok kémiai elem, hidrogén, oxigén, stb
- álló anyag atomok különböző kémiai elemek, savat, vizet és másokat.
- az a képesség, az egyes kémiai elemek léteznek két vagy több egyszerűbb anyagok különböző szerkezetű és tulajdonságú. Például: gyémánt és a szén áll az azonos elem - a szén.
A relatív atomtömeg.
Relatív atomtömeg elem aránya abszolút tömeg atommal 1/12 12C abszolút tömegű izotópot szénatomos. Képviselnek relatív atomtömeg elem szimbólum Ar, ahol r - első betűjét az angol szó relatív (Relatív).
Relatív molekulatömeg.
Relatív molekulatömeg MR az aránya abszolút tömeg molekulatömege 1/12 egy szénatomhoz a 12C-izotóp.
Megjegyezzük, hogy a relatív súlya definíció szerint dimenzió nélküli mennyiség.
Így, amely a relatív atomi és molekuláris súlyok választott 1/12 tömegrész szénizotóp 12 szénatomos, amely az úgynevezett atomi tömegegység (amu):
A kémiában különleges jelentősége van a szélsőséges érték - anyagmennyiség.
Az anyagmennyiség száma határozza meg a szerkezeti egységek (atomok, molekulák, ionok vagy más részecskék) Ennek az anyagnak, azt általában jelöljük n, és van kifejezve mol (mól).
- egységnyi anyag mennyisége tartalmazó azonos mennyiségű szerkezeti egységet az anyag, mint amilyenek az szénatomot 12 g, amely csak a 12C-izotóp.
Meghatározása mól száma alapján az egységek, amelyek 12 g szén. Megállapítást nyert, hogy a szén-dioxid-tömeget tartalmaz 6,02 × 1023 szénatom. Következésképpen, bármilyen mennyiségű anyag 1 mol 6,02 × 1023 tartalmaz szerkezeti egységeket (atomok, molekulák vagy ionok).
Részecskék száma 1023 6,02 × Avogadro hívott szám vagy az Avogadro-állandót és jelöljük NA:
NA = 6,02 × 23 okt mol -1
A kényelem kedvéért a számítások alapján végzett kémiai reakciók, valamint figyelembe véve a mennyiségű kiindulási reagensek és a reakció termékek mól, a koncepció molekulatömegű anyagok.
A moláris tömege
anyag aránya a tömegét, hogy az anyag mennyiségét:
ahol g - súlya grammban, n - az anyag mennyiségét mól, M - moláris tömege g / mol - állandó értéket minden egyes adott vegyület.
Móltömeg numerikusan azonos relatív molekulatömegű anyag, vagy egy relatív atomtömeg elem.
- képessége atomok kémiai elemek formálják a bizonyos számú kémiai kötéseket tartalmazó más elemek vagy a kapcsolatok száma, hogy képezhetnek anyag.
(Oxidációs számot, formai töltése) - kiegészítő feltételes érték a felvétel az oxidáció, redukció és oxidációs-redukciós reakciókban, a számértéke az elektromos töltés tulajdonítható tartalmaz a molekulában, feltételezve, hogy az elektron párokat kommunikáló teljesen kiszorította felé több elektronegatív atom.
Bemutatása oxidációs foka alapján osztályozási és nevezéktana szervetlen vegyületek.
Az oxidáció mértéke megfelel a töltés az ion vagy atom a formális felelős a molekula vagy a általános képletű egység, például:
A oxidációs állapota egy elem van feltüntetve a tetején a szimbólum. Ellentétben utasításait az ion töltése, az első jelzés kerül megadásával az oxidáció mértékét, majd a számérték, és nem fordítva.
H + N +3 O -2 2 - oxidációs állapotban, H + N 3+ O 2- 2 - díjakat.
A oxidációs állapotát egy atom egy egyszerű anyag nulla, például:
Az algebrai összege oxidációs állapotai atom a molekula mindig nulla:
kölcsönös vonzás atomok, képződéséhez vezető molekulák és a kristályok. Azt mondjuk, hogy egy molekulában vagy kristály, vannak közötti kémiai kötések szomszédos atomokban. Kémiai kötés által meghatározott közötti kölcsönhatás a töltött részecskék (elektronok és az atommagok). Főbb jellemzői a kémiai kötés - szilárdság, hossza, polaritása.
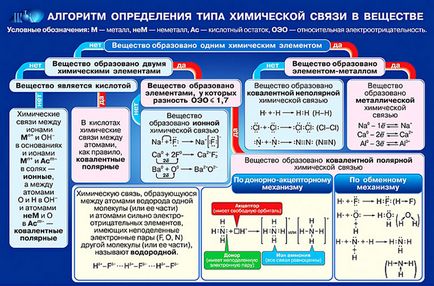
- attribútumok, amellyel az egyik anyag különbözik a többi, azok fizikai és kémiai.
- jeleit anyag, mely anyag jellemzése nem változik a kémiai összetétele. (sűrűség, fizikai állapot, olvadás- és forráspontja, stb)
- képesek kölcsönhatásba más alapanyaggal vagy anyaggal fogja változtatni a hatása alatt bizonyos usloviy.Rezultatom átalakítás egyik anyagot vagy anyagokat más anyagokkal.
Fizikai jelenségek - az új anyag nem képződik.
Kémiai jelenségek - új anyag képződik.